Une découverte en mécanobiologie, réalisée grâce à un microscope à force atomique, ouvre de nouvelles perspectives dans la lutte contre les maladies nosocomiales provoquées par les staphylocoques.
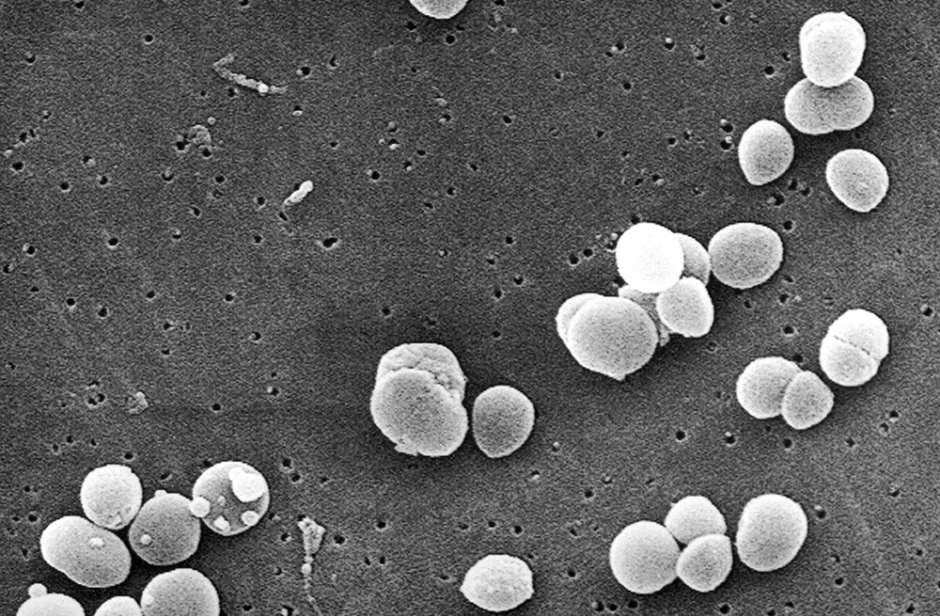
Parfois surnommés les « tueurs des hôpitaux », les staphylocoques dorés (Staphylococcus aureus) sont, avec une autre bactérie elle aussi très connue, Escherichia coli, rendus responsables de la majorité des maladies nosocomiales, c’est-à-dire contractées à l’hôpital. Les staphylocoques, que l’on trouve fréquemment dans l’eau sale, les sols, etc., s’ils peuvent aussi être responsables d’intoxications alimentaires, sont cependant des habitués de notre peau et nos muqueuses externes puisque, selon l’Institut Pasteur, 30 à 50% de la population sont porteurs sains de staphylocoques, c’est-à-dire porteurs de la bactérie sans développer de maladie. Ils sont donc considérés comme des membres de notre flore bactérienne naturelle. Quand provoquent-ils alors des infections ? En dehors du cas d’ingestion d’aliments contaminés, qui ne nous occupe pas ici, les contaminations peuvent survenir en cas de blessure puisque la barrière cutanée est alors rompue, mais aussi lors d’interventions chirurgicales. Les pathologies qui en résultent sont cependant le plus souvent maîtrisées par des traitement par antibiotique. Mais pas toujours…. D’abord parce que beaucoup de souches de staphylocoques sont devenues résistantes à ce type de traitement mais aussi parce que les staphylocoques ont la fâcheuse tendance à former des biofilms. Et c’est à eux que le Professeur Yves Dufrêne, Directeur de recherche du FNRS au Louvain Institute of Biomolecular Science and Technology (LIBST) de l’UCL et chercheur Welbio s’est attaqué depuis plusieurs années déjà. « Ces biofilms sont des communautés de bactéries pouvant contenir plusieurs milliards d’entre elles, explique Yves Dufrêne. Elles adhèrent à des surfaces –des tissus humains mais aussi les surfaces de dispositifs médicaux comme des cathéters, des sondes ou des prothèses, secrètent une gangue, se multiplient, s’agrègent entre elles et forment une couche très collante, très difficile à éradiquer. » Curieusement en effet, même lorsque les bactéries individuelles sont sensibles aux antibiotiques, lorsqu’elles forment un biofilm, elles y résistent. Les biofilms sont dès lors jugés responsables de 60 à 80% des infections nosocomiales. La lutte contre ceux-ci est donc devenue un enjeu médical majeur. « L’enjeu de nos recherches, précise Yves Dufrêne, est de bloquer l’adhésion des bactéries plutôt que d’utiliser des antibiotiques. Elles n’adhèrent pas par hasard, elles ont développé en surface des protéines-clés, appelées adhésines ou protéines d’adhésion qui ont une interaction clé-serrure très spécifique. Désactiver celles-ci rend la bactérie non adhérente et c’est ce que nous essayons de réaliser. »
Mécanobiologie
En 2015 déjà, l’équipe d’Yves Dufrêne découvre qu’une protéine située sur la surface du staphylocoque, SasG, joue un rôle dans le phénomène d’adhésion des bactéries les unes aux autres : mise en présence de zinc, SasG se comporte comme une bande velcro qui s’attache au velcro des bactéries voisines. L'’an dernier l’équipe louvaniste franchit un grand pas puisqu’elle identifie une molécule capable d’inactiver une protéine d’adhésion majeure qui permet aux staphylocoques de former des biofilms. Il s’agit d’un peptide dérivé d’une molécule neuronale, la β-neurexine. Ces deux découvertes majeures ont pu être réalisées grâce au développement d’un nouveau champ de la biologie : la mécanobiologie.
Cette discipline, qui étudie comment les cellules réagissent aux forces mécaniques, a pris son essors voici une vingtaine d’années. Elle est née d’un constat : comment comprendre le mode d’action des cellules dans leur environnement biochimique si on néglige leur capacité à exercer des forces mécaniques et à y réagir ? Un élément essentiel car les cellules utilisent ces tensions et pressions pour s’adapter à leur environnement, par exemple pour migrer ou au contraire adhérer à un support. En fait, les interactions de cellules entre elles ou avec leur environnement sont influencées par les sollicitations mécaniques qui s’exercent sur elles. Ainsi, par exemple, on a observé que des cellules épithéliales, comme celles qui forment la peau ou la paroi de l’intestin communiquent via des forces mécaniques pour coordonner leurs mouvements. Autre exemple : en étirant des cellules, des chercheurs ont constaté que cela accroissait l’activité de deux protéines intracellulaires (YAP et TAZ), provoquant une réplication incontrôlable des cellules…. comme si elles devenaient ‘cancéreuses’. Ou encore que des cellules qui disposent d’espace continuent à se diviser, alors que celles qui sont confinées le font beaucoup plus lentement. On comprend dès lors que ce secteur de la biologie intéresse de plus en plus des domaines aussi variés que la cancérologie, le développement des embryons, la cicatrisation, et plus récemment la microbiologie, et plus particulièrement la formation des biofilms bactériens.
Le microscope à force atomique
Si ces avancées ont été possibles, c’est aussi grâce à des développements technologiques en nanoscopie du vivant. « Dans notre travail, comme dans beaucoup d’autres en mécanobiologie, explique Yves Dufrêne, il faut observer le comportement des protéines, encore bien plus petites que les cellules. On est ici dans l’ordre du nanomètre, le millionième de millimètre, ce qui n’est pas observable par des microscopes optiques. »
En microscopie optique, le grossissement est limité par la longueur d’onde de la lumière. La microscopie électronique, apparue en 1931, permet des grossissements beaucoup plus élevés, en utilisant des électrons plutôt que des photons. Plus récemment, de nouvelles microscopies « à sondes locales » sont apparues, permettant pour la première fois de « voir » et "sentir" les atomes et les molécules. Le principe est radicalement différent des autres microscopes puisqu’ici on utilise non plus un rayonnement incident (photons, électrons) mais une sonde miniature se déplaçant à très faible distance de la surface à analyser. Ainsi, en biologie, le microscope à force atomique (AFM) autorise l’observation du vivant à l'échelle nanométrique, et ce, directement en milieu liquide, ce que ne permet pas le microscope électronique. Inventé en 1986 par les physiciens Heinrich Rohrer, Gerd Binning et Calvin Quate, l’AFM réalise une cartographie en 3D et caractérise les propriétés physiques d’un matériau à l’échelle nanométrique. Pour y arriver, il détecte les forces atomiques qui s’exercent entre la surface de l’échantillon et une pointe qui se déplace à très faible distance au-dessus d’elle. La pointe qui se trouve au bout d’un levier déformable quand il est soumis à une perturbation (ce qui permet l’enregistrement de celle-ci) doit être la plus fine possible, Mais le système, et c’est ce qui nous intéresse particulièrement ici, permet aussi une mesure des forces observées !
Des forces décuplées en cas de stress !
« Si les bactéries s’agrègent entre elles ou à des parois, c’est parce que des protéines à leur surface développent des forces d’adhésion. Notre but était donc de mesurer ces forces grâce à l’AFM afin de mieux connaître comment ces protéines fonctionnent. C’est exceptionnel de réaliser cela avec des bactéries vivantes, s’enthousiasme Yves Dufrêne ! » Avec quels résultats ? Au repos, les forces observées sont évidemment très faibles (on est ici dans l’ordre du pico newton (10-12N)), mais cette valeur est multipliée par plusieurs ordres de grandeur lorsque la protéine est ‘stressée’, par exemple quand on l’étire. « On atteint alors, explique Yves Dufrêne, des valeurs équivalentes à un lien covalent. Mesurer cela dans le vivant, c’est tout à fait exceptionnel, inattendu.» Autrement dit, les chercheurs louvanistes ont observé un phénomène majeur : le pouvoir adhérent des protéines d’adhésion est fortement renforcé quand ces protéines sont sujettes à un stress mécanique ! Or ce stress, c’est exactement ce qui caractérise en quelque sorte le quotidien de nos staphylocoques : que ce soit dans le flux sanguin, sur les cathéters ou sur la peau (quand on se gratte par exemple) ou même dans les biofilms quand ils se multiplient, ils sont soumis à des turbulences, des chocs.
Dans leur dernière étude publiée dans la revue PNAS(1) et réalisée avec des collègues du Trinity College de Dublin, les chercheurs louvanistes se sont intéressés à une protéine d’adhésion particulière, la protéine ClfA, qui a la particularité de fonctionner en interaction ‘clé-serrure’ avec le fibrinogène, une protéine du plasma sanguin très présente sur les dispositifs médicaux. En cas de tension mécanique, de stress, ce dispositif clé-serrure qui lie les deux types de protéines se renforce considérablement et le staphylocoque adhère plus que jamais au biomatériau. Une étude financée par le Welbio et l’ERC (European Research Council, https://erc.europa.eu).
Henri Dupuis
(1) Staphylococcus aureus clumping factor A is a force-sensitive molecular switch that activates bacterial adhesion, Ph. Herman-Bausier et al., PNAS, May 7, 2018. https://doi.org/10.1073/pnas.1718104115
Le fonctionnement de l’AFM
Ce microscope n’utilise pas de rayons incidents mais une sonde constituée d’un levier terminé par une pointe le plus fine possible, idéalement un seul atome. Si l’atome-pointe est proche des atomes de la surface de l’échantillon, une force répulsive va naître qui augmente rapidement avec l’inverse de la distance car les nuages électroniques des ions vont se recouvrir. Si par contre pointe et échantillon sont plus éloignés (mais ‘conscients’ de la présence des uns et des autres !), une force attractive (dite de Van der Waals) va les faire se rapprocher. En déplaçant la pointe sur l’échantillon (on ‘scanne’ l’échantillon), on obtient ainsi une succession d’attirances et de répulsions qui est évidemment enregistrée par le levier et, in fine, forme une cartographie 3D de la surface.
Coup d'oeil sur la bio de Yves Dufrêne

1991 Diplômé de la Faculté des bioingénieurs Agro Louvain de l’UCL
1996 Thèse de doctorat à l’UCL
1996-97 Postdoctorat au Naval Research Laboratory (USA)
Depuis 2000 Chercheur FNRS (maitre de recherche) l’Institut des sciences de la Vie de l’UCL et professeur à la Faculté des bioingénieurs Agro Louvain de l’UCL
2009 Lauréat du Prix Pacault de la Société française de Chimie
2012 Lauréat du Quadrennial Life Sciences Award de la Société européenne de Microscopie
2013 Lauréat du prix Léo Errera de l’Académie royale de Belgique
2015 Editeur associé de la revue Nanoscale
2016 Lauréat du Conseil européen de la Recherche (ERC advanced grant pour le projet de recherche NanoStaph)

